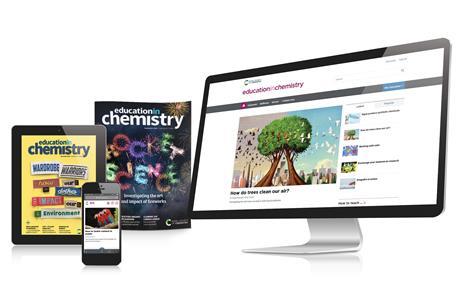
Produire de l'hydrogène de manière plus durable ?
En utilisant uniquement des matières premières peu coûteuses et abondantes sur terre, avec un apport d'énergie lumineuse et dans des conditions produisant peu de déchets Yuan et al.(2022) ici ont créé un photocatalyseur évolutif capable de convertir l'ammoniac en hydrogène cf. figure. Cet Hydrogène est appelé à jouer une rôle important dans la transition énergétique. Des prototypes sont déjà developpés par Syzygy Plasmonics Inc. dans lequel trois des co-auteurs ont des intérêts.
Un catalyseur et un apport de lumière (LED) pour produire l'ammoniac plus durablement
| Plasmonique discipline cherchant à tirer profit de l'interaction résonante obtenue dans certaines conditions entre un rayonnement électromagnétique (lumineux notamment) et les électrons libres à l'interface entre un métal et un matériau diélectrique (air ou verre par exemple). Cette interaction génère des ondes de densité d'électrons, se comportant comme des vagues et appelées plasmons ou plasmons de surface. Source : futura-sciences.com |
Exploiter le fer pour la photocatalyse
| La désorption est la transformation inverse de la sorption (adsorption ou absorption), par laquelle les molécules absorbées (ou adsorbées) se détachent du substrat. |
Abstract de Yuan, et al. (2022)
"Les catalyseurs à base de métaux du groupe du platine sont au centre des préoccupations de l'industrie chimique depuis des décennies. Nous montrons que la photocatalyse plasmonique peut transformer un métal de transition thermiquement non réactif et riche en terre en un site catalytiquement actif sous illumination. Les sites actifs Fe dans un complexe antenne-réacteur Cu-Fe atteignent des efficacités très similaires à Ru pour la décomposition photocatalytique de l'ammoniac sous éclairage pulsé ultrarapide. Lorsqu'ils sont éclairés par des diodes électroluminescentes plutôt que par des lasers, les efficacités photocatalytiques restent comparables, même lorsque l'échelle de réaction augmente de près de trois ordres de grandeur. Ce résultat démontre le potentiel d'une production d'hydrogène hautement efficace avec de l'électricité à partir d'un support d'ammoniac avec des métaux de transition abondants dans la terre." Traduction de Yuan et al.(2022) La prudence dans la conclusion de Yuan, et al. (2022)
Bien que la section " Competing interests" dans toutes les revues scientifiques sérieuses oblige les auteurs à révéler leurs intérêts (on y lit que 3 des co-auteurs ont des participations dans Syzygy Plasmonics Inc. (et que leur publicité, ainsi que la vulgarisation risquent d'être bien plus sensationnalliste), la publication dans Science exige un ton très modéré et prudent :
"…Cette étude suggère que les métaux de transition, traditionnellement considérés comme inadaptés à la thermocatalyse conventionnelle, peuvent être des substrats pertinents pour la photocatalyse plasmonique et démontre également que la photocatalyse peut être efficacement réalisée avec des sources de photons LED peu coûteuses. Ces résultats motivent fortement l'étude de métaux plus abondants pouvant servir de sites réactifs très efficaces pour la photocatalyse antenne-réacteur plasmonique. " Traduction de Yuan et al.(2022)![]() encourage le lecteur à aller vérifier dans l'article d'origine :ici
encourage le lecteur à aller vérifier dans l'article d'origine :ici
Bio-inspiré ?
- Cortés, E. (2023). Light-activated catalysts point the way to sustainable chemistry. Nature, 614(7947), 230‑232. https://doi.org/10.1038/d41586-023-00239-2
- Yuan, Y., Zhou, L., Robatjazi, H., Bao, J. L., Zhou, J., Bayles, A., Yuan, L., Lou, M., Lou, M., Khatiwada, S., Carter, E. A., Nordlander, P., & Halas, N. J. (2022). Earth-abundant photocatalyst for H2 generation from NH3 with light-emitting diode illumination. Science, 378(6622), 889‑893. https://doi.org/10.1126/science.abn5636