Le modèle scolaire de l'électronégativité dans la force des liaisons chimiques affiné...
Les savoirs dans les manuels sur la façon de déterminer les forces des liaisons chimiques semblent être simplifiées à l'extrême, dit Flora Graham dans une Daily briefing de Nature au titre provocant : Time to rewrite the textbooks on chemical-bond strength
Les liaisons chimiques sont généralement plus fortes entre les atomes qui ont une plus grande différence dans leur électronégativité - qui est influencée par le nombre de protons dans le noyau et l'organisation des électrons. Mais dans certains cas, les chercheurs ont découvert que les différences de taille des atomes, plutôt que leur électronégativité, déterminent la force de la liaison. La stabilité et la longueur des liaisons chimiques sont des facteurs clés dans la structure et la réactivité des molécules, il est donc important de les comprendre pour développement: des produits pharmaceutiques jusqu'aux matériaux. Traduction JTS de Graham, F. (2021).
« C'est un rappel intrigant qu'en science, on doit toujours se méfier de donner une réponse simple », Catharine Esterhuysen, chimiste structurelle.
Chevallard (1991), ne serait pas surpris : en analysant les transformations des savoirs depuis la recherche jusqu'en classe (la transposition didactique), il a montré que pour enseigner ces transformations sont nécessaires et inévitable.
Mais elles font perdre une part de ce qui fait qu'un savoir soit scientifique : sa fraîcheur, sa validation, ses méthodes, son contexte…
Mais elles font perdre une part de ce qui fait qu'un savoir soit scientifique : sa fraîcheur, sa validation, ses méthodes, son contexte…
Les enseignants de chimie devront affronter ce dilemme, avec cette nouvelle étude. Entre des savoirs identifiables dans les programmes, socialement reconnus, présentés comme définitifs, aisément exercisables, évaluables, … et une science qui progresse, nuance, affine les modèles explicatifs en les justifiant sur la base de données expérimentales discutées.
Commentaire par Kira Welter (2021) dans Chemistry World
Traduction JTS. Le rôle de l'électronégativité dans la détermination des forces de liaison doit être repensé.
Elle commente l'étude de Blokker, et al (2021). Les liaisons chimiques deviennent généralement plus fortes à mesure que la différence d'électronégativité entre leurs atomes participants augmente. Mais les scientifiques ont maintenant trouvé des preuves qui sapent ce qu'ils disent être les connaissances des manuels : dans certains cas, les différences de taille des atomes, et non les différences d'électronégativité, déterminent les tendances des forces de liaison. « L'une des exceptions frappantes au modèle d'électronégativité est la série de liaisons carbone-halogène qui – ironiquement – est un exemple populaire pour illustrer cette approche simplifiée », note Matthias Bickelhaupt, directeur de l'étude de la Vrije Universiteit Amsterdam et de l'Université Radboud aux Pays-Bas.
Elle commente l'étude de Blokker, et al (2021). Les liaisons chimiques deviennent généralement plus fortes à mesure que la différence d'électronégativité entre leurs atomes participants augmente. Mais les scientifiques ont maintenant trouvé des preuves qui sapent ce qu'ils disent être les connaissances des manuels : dans certains cas, les différences de taille des atomes, et non les différences d'électronégativité, déterminent les tendances des forces de liaison. « L'une des exceptions frappantes au modèle d'électronégativité est la série de liaisons carbone-halogène qui – ironiquement – est un exemple populaire pour illustrer cette approche simplifiée », note Matthias Bickelhaupt, directeur de l'étude de la Vrije Universiteit Amsterdam et de l'Université Radboud aux Pays-Bas.
Changement de paradigme !
Les
liaisons chimiques en général deviennent plus fortes à mesure que la
différence d'électronégativité à travers la liaison augmente. Cette
corrélation a jusqu'ici été considérée comme causale mais, ici, nous
montrons qu'elle ne l'est pas dans certains cas remarquables. Par
exemple, les liaisons carbone-halogène s'affaiblissent de C-F à C-I,
malgré des interactions orbitales plus fortes (pas plus faibles) à
mesure que le chevauchement des liaisons augmente, en raison de la
répulsion de Pauli plus forte avec l'halogène plus grand et plus riche
en électrons. Blokker et al. (2021). Traduction JTS
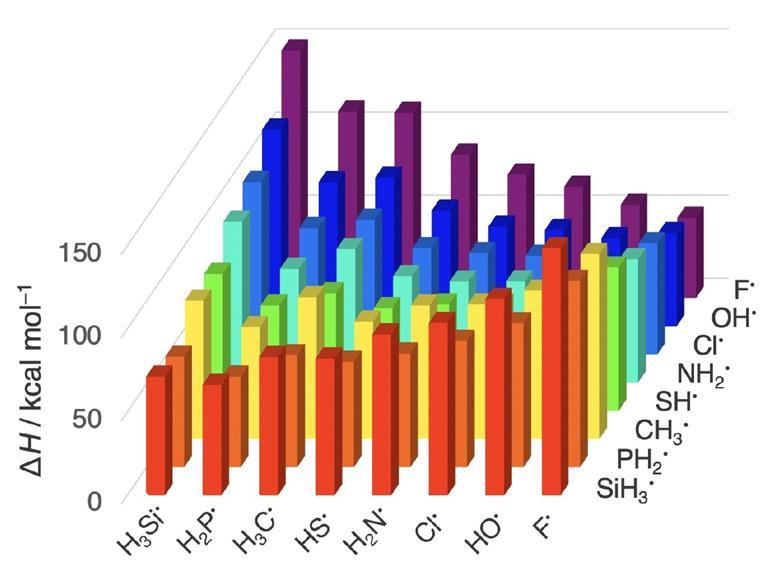
Fig 1: Histogramme 3D montrant les enthalpies de dissociation des liaisons (ΔH) sur l'axe z et les atomes allant du moins électronégatif (silicium) au plus électronégatif (fluor) sur les axes x et y [img].Source : © 2021 Blokker et al. (2021)
Selon Kira Welter (2021), cela montre que, dans certains cas, la relation entre les enthalpies de dissociation des liaisons (ΔH) et l'électronégativité est simplement un sous-produit d'un mécanisme différent lié aux différences de taille des atomes. La structure et la réactivité des molécules dépendent fortement de la stabilité et de la longueur des liaisons chimiques, il est donc crucial de comprendre comment ces paramètres varient pour différentes combinaisons élément-élément dans le tableau périodique. "Cela peut aider les scientifiques à concevoir de meilleures méthodes pour produire de nouvelles molécules, telles que des composés pharmaceutiques et des matériaux fonctionnels", explique Catharine Esterhuysen, experte en liaisons chimiques à l'Université de Stellenbosch, en Afrique du Sud, qui n'a pas participé à l'étude.
À l'aide de la théorie de la densité fonctionnelle (density functional theory) , l'équipe néerlandaise a analysé « des liaisons élément-élément impliquant des atomes des périodes 2 et 3 et des groupes 14 à 17, qui représentent une série systématique de situations de liaison typiques à travers le tableau périodique, […] « Ces liens sont omniprésents dans les sciences chimiques et figurent dans les produits naturels, les produits chimiques et les matériaux. » « Les [chercheurs] montrent que le long d'une période, la variation de l'électronégativité est bien à l'origine de la tendance de la force de liaison ; c'est au sein d'un groupe que le modèle traditionnel s'effondre », commente Esterhuysen.
![]() encourage le lecteur à aller vérifier dans le commentaire de Kira Welter (2021) dans Chemistry World : ici
encourage le lecteur à aller vérifier dans le commentaire de Kira Welter (2021) dans Chemistry World : ici
Elle explique que l'équipe de Bickelhaupt (Blokker, et al. 2021) a soigneusement analysé comment l'énergie de liaison entre deux atomes change à mesure qu'ils se rapprochent. De tels changements d'énergie ont plusieurs composantes en raison des différentes manières dont les électrons et les noyaux interagissent les uns avec les autres. « Les chercheurs ont décomposé l'énergie de liaison en composants, à l'aide du modèle de contrainte d'activation et de l'analyse de décomposition de l'énergie, puis ont examiné leur influence relative », explique Esterhuysen. Cela leur a permis d'identifier les forces derrière la formation de différents liens et de découvrir comment ceux-ci évoluent au travers des périodes et des groupes.
Fig. 2 : Les liaisons chimiques en général deviennent plus fortes à mesure que la différence d'électronégativité à travers la liaison n'augmente pas dans tous les cas remarquables. Par exemple, les liaisons carbone-halogène s'affaiblissent de C-F à C-I, malgré des interactions orbitales plus fortes (pas plus faibles) à mesure que le chevauchement des liaisons augmente, en raison de la répulsion de Pauli plus forte avec l'halogène plus grand et plus riche en électrons [img].Source : © 2021 Blokker et al. (2021)
"Au long d'une période, par exemple du carbone-carbone au carbone-fluor, les liaisons se renforcent parce que la différence d'électronégativité entre elles augmente à mesure que la paire d'électrons de liaison se stabilise de plus en plus sur l'atome le plus électronégatif", observe Bickelhaupt. Mais « dans un groupe, par exemple du carbone-fluor au carbone-iode, l'augmentation de la taille effective des atomes est le facteur causal de l'affaiblissement de la liaison, via l'augmentation de la répulsion stérique de Pauli ».
Le fait que l'étude ait évalué plusieurs distances élément-élément, et pas seulement la géométrie d'équilibre, est important car c'est le seul moyen de découvrir ce qui détermine la formation de liaisons, ajoute Bickelhaupt.
« Notre mécanisme intuitif "effective-atomic-size bonding mechanism" peut être appliqué pour comprendre la longueur et la solidité de la liaison pour plusieurs séries de liaisons dans le tableau périodique", dit-il.
« Notre mécanisme intuitif "effective-atomic-size bonding mechanism" peut être appliqué pour comprendre la longueur et la solidité de la liaison pour plusieurs séries de liaisons dans le tableau périodique", dit-il.
« Comme le soulignent les [chercheurs], si l'on veut vraiment obtenir une compréhension complète d'un mécanisme de liaison, il doit être étudié à un niveau profond et fondamental.
 encourage le lecteur à aller vérifier dans l'article d'origine de Blokker, et al (2021) : ici
encourage le lecteur à aller vérifier dans l'article d'origine de Blokker, et al (2021) : ici
- Blokker, E., Sun, X., Poater, J., van der Schuur, J. M., Hamlin, T. A., & Bickelhaupt, F. M. (2021). The Chemical Bond : When Atom Size Instead of Electronegativity Difference Determines Trend in Bond Strength. Chemistry – A European Journal, 27(63), 15616‑15622. https://doi.org/10.1002/chem.202103544
- Chevallard, Y. (1991). La transposition didactique. Du savoir savant au savoir enseigné (2e éd. revue et augmentée, 1985 lre). La Pensée sauvage.
- Graham, F. (2021). Daily briefing : Time to rewrite the textbooks on chemical-bond strength. Nature. https://doi.org/10.1038/d41586-021-03480-9
- Welter, K. W. (2021). Textbook electronegativity model fails when it comes to carbon–halogen bond strengths. Chemistry World. Consulté 7 décembre 2021, à l'adresse https://www.chemistryworld.com/news/textbook-electronegativity-model-fails-when-it-comes-to-carbon-halogen-bond-strengths/4014750.article
- Mise à jour le 9 déc.21 : corrigé coquilles


Aucun commentaire:
Enregistrer un commentaire