Une nouvelle technique de microscopie : déjà de nombreuses applications … venez entendre la chercheuse et le chercheur qui l'ont inventée!
VOIR C'EST SAVOIR : DU MICROSCOPE À LA DÉCOUVERTE SCIENTIFIQUES'appuyant sur la technique de Hamel et Guichard, Labade, et al. (2024) ici ont developpé une nouvelle technique de microscopie que Heidi Ledford, (2024) dans une news de Nature ici décrit cette technique « phénoménale » qui permet aux scientifiques d'observer l'interaction des protéines et des chromosomes dans une cellule intacte. La méthode, appelée séquençage génomique in situ par expansion (expansion in situ genome sequencing (ExIGS)), a été décrite dans une prépublication publiée sur bioRxiv le 26 septembre. Cela signifie qu'elle n'a pas encore été évaluée par le processus classique de Reviewing qui valide la publication. Adaptation de Ledford, H. (2024)
Dre Virginie Hamel et Prof. Paul Guichard, Département de biologie moléculaire et cellulaire, UNIGE
Lors de cette conférence à deux voix, nous partagerons notre complémentarité en recherche scientifique, illustrant comment la synergie entre nos approches contribue à la production de savoirs. Nous parcourrons les étapes du cycle scientifique, de l'hypothèse aux expériences, de l'interprétation à la diffusion, en mettant en lumière notre collaboration autour de la microscopie à expansion. Cette technique révolutionnaire d'imagerie nanoscopique qui est au coeur de notre recherche, nous permet de lier recherche fondamentale et médicale pour de nouvelles perspectives scientifiques.
La biologie descriptive ET la fonctionnalité interne d'une cellule à un moment donné ?
La microscopie (qui révèle plutôt la structure) et la génomique (qui fournit plutôt des information sur l'expression des gènes et le fonctionnement) sont toutes deux utilisées pour étudier les cellules, mais les approches permettant de relier ces deux types d'informations sont rares, en particulier à une résolution subnucléaire.(trad. JTS)
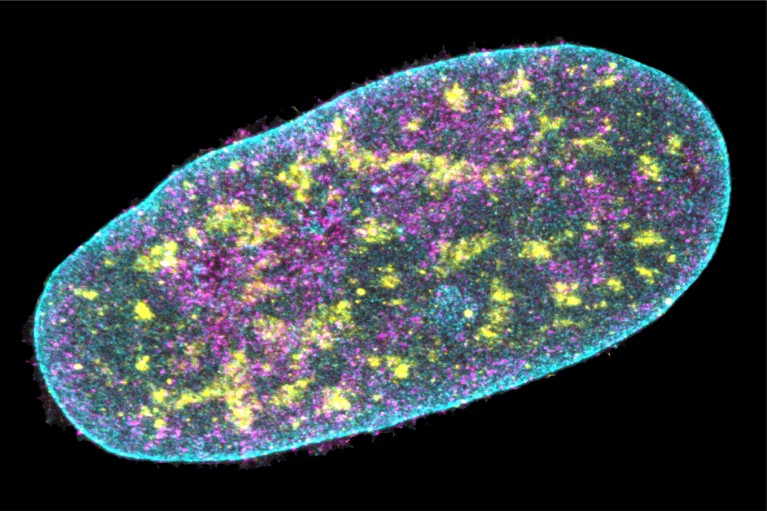
Fig 1: Le séquençage génomique in situ par expansion nouvelle méthode d'imagerie révèle diverses protéines (bleu, jaune et magenta)
à l'intérieur du noyau d'une cellule de tissu conjonctif humain. [img]. Source : Ajay Labade, Zachary Chiang, Caroline Comenho et Jason Buenrostro
De nombreux chercheurs se précipitent pour tester cette puissante technique de microscopie capable de séquencer simultanément l'ADN d'une cellule individuelle et de localiser ses protéines avec une grande précision, sans avoir à ouvrir la cellule ni à en extraire le contenu. Imager l'ADN et les protéines dans des cellules intactes fournit des informations cruciales sur la façon dont ces molécules interagissent.
Labade, et al. (2024) ici qui ont développé cette méthode, l'ont déjà utilisée pour étudier comment le vieillissement pourrait modifier les interactions entre les protéines du noyau et les chromosomes. Ils ont découvert que, avec l'âge, des changements dans ces protéines nucléaires semblent réprimer l'activité des gènes.Adaptation de Ledford, H. (2024) ![]() encourage le lecteur à aller vérifier dans l'article d'origine : ici
encourage le lecteur à aller vérifier dans l'article d'origine : ici
Révéler l'organisation de l'ADN
Cette approche pourrait être particulièrement utile pour les chercheurs étudiant comment l'ADN est enroulé autour des protéines et empaqueté dans les noyaux cellulaires, et comment la position des gènes dans cette masse peut influencer leur activité. « On peut considérer l'ADN comme une "ficelle linéaire d'informations" qui doit être compressée et organisée dans un noyau cellulaire de 5 microns », explique Jason Buenrostro, généticien à l'Université Harvard à Cambridge, Massachusetts, et auteur de la prépublication. « Il y a beaucoup d'informations dans la manière dont cet empaquetage se fait. » Pour extraire ces informations, Buenrostro et ses collègues ont combiné deux méthodes déjà existantes. La première utilise une enzyme spéciale pour copier l'ADN, associée à des composants d'ADN marqués avec des fluorescences qui s'intègrent, un par un, dans les nouvelles chaînes d'ADN. En lisant la séquence d'ajout des marqueurs fluorescents, les chercheurs peuvent déterminer la séquence des fragments du génome. Adaptation de Ledford, H. (2024) ![]() encourage le lecteur à aller vérifier dans l'article d'origine : ici
encourage le lecteur à aller vérifier dans l'article d'origine : ici
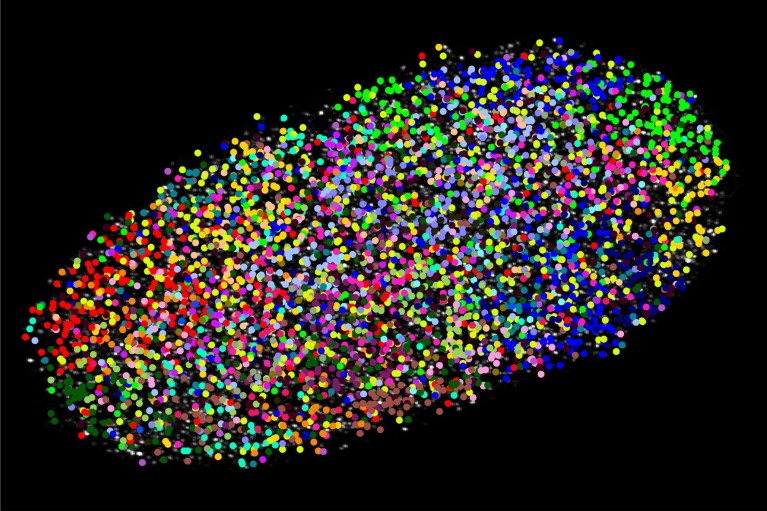
Fig 2 : Le séquençage génomique in situ par expansion révèle des informations génomiques : Chaque couleur représente un chromosome différent dans le noyau de la même cellule de tissu conjonctif.
[IMG] Crédit : Ajay Labade, Zachary Chiang, Caroline Comenho et Jason Buenrostro
Les chercheurs savent depuis longtemps comment marquer les protéines pour suivre leur position. Mais la résolution de la microscopie optique est limitée par la longueur d'onde de la lumière, ce qui rend difficile de distinguer des brins d'ADN ou des protéines très proches les uns des autres — un problème particulièrement délicat dans le noyau étroit. C'est pourquoi l'équipe a ajouté une méthode appelée microscopie par expansion. Cette technique repose sur un gel qui pénètre dans les cellules et gonfle lorsqu'il absorbe de l'eau, comme le matériau des couches jetables. Lorsque le gel se dilate, il écarte les molécules, rendant plus facile la distinction entre elles. Adaptation de Ledford, H. (2024) ![]() encourage le lecteur à aller vérifier dans l'article d'origine : ici
encourage le lecteur à aller vérifier dans l'article d'origine : ici
Premières applications prometteuses
Cette combinaison a permis à l'équipe de Buenrostro d'étudier les interactions entre protéines et gènes dans les cellules de personnes atteintes du syndrome de Hutchinson-Gilford (progeria), une maladie génétique entraînant un vieillissement prématuré. Cette maladie est causée par des mutations dans les protéines appelées lamines, normalement situées à la périphérie du noyau cellulaire. Les chercheurs ont confirmé que chez les individus atteints de progeria, ces lamines anormales envahissent l'intérieur du noyau, où elles semblent altérer l'organisation des chromosomes et réprimer l'activité des gènes. Des anomalies similaires ont été observées dans des cellules de peau d'un donneur âgé de 92 ans n'ayant pas de progeria.
Abstract de Labade, et al. (2024)
"Microscopy and genomics are both used to characterize cell function, but approaches to connect the two types of information are lacking, particularly at subnuclear resolution. While emerging multiplexed imaging methods can simultaneously localize genomic regions and nuclear proteins, their ability to accurately measure DNA-protein interactions is constrained by the diffraction limit of optical microscopy. Here, we describe expansion in situ genome sequencing (ExIGS), a technology that enables sequencing of genomic DNA and superresolution localization of nuclear proteins in single cells. We applied ExIGS to fibroblast cells derived from an individual with Hutchinson-Gilford progeria syndrome to characterize how variation in nuclear morphology affects spatial chromatin organization. Using this data, we discovered that lamin abnormalities are linked to hotspots of aberrant euchromatin repression that may erode cell identity. Further, we show that lamin abnormalities heterogeneously increase the repressive environment of the nucleus in tissues and aged cells. These results demonstrate that ExIGS may serve as a generalizable platform for connecting nuclear abnormalities to changes in gene regulation across disease contexts." ![]() encourage le lecteur à aller vérifier dans l'article d'origine : ici
encourage le lecteur à aller vérifier dans l'article d'origine : ici
Références:
- Labade, A. S., Chiang, Z. D., Comenho, C., Reginato, P. L., Payne, A. C., Earl, A. S., Shrestha, R., Duarte, F. M., Habibi, E., Zhang, R., Church, G. M., Boyden, E. S., Chen, F., & Buenrostro, J. D. (2024). Expansion in situ genome sequencing links nuclear abnormalities to hotspots of aberrant euchromatin repression (p. 2024.09.24.614614). bioRxiv. https://doi.org/10.1101/2024.09.24.614614
- Ledford, H. (2024). 'Phenomenal' tool sequences DNA and tracks proteins—Without cracking cells open. Nature, 634(8035), 759‑760. https://doi.org/10.1038/d41586-024-03276-7


Aucun commentaire:
Enregistrer un commentaire